肝・胆・膵外科
診療スタッフ
-
 岸 庸二
岸 庸二-
資格等
- 日本外科学会専門医、指導医
- 日本消化器外科学会専門医、指導医、評議員
- 消化器がん外科治療認定医
- 日本がん治療認定医機構がん治療認定医
- 日本肝胆膵外科学会高度技能指導医、評議員、
技術認定委員 - 日本肝臓学会肝臓専門医
-
2019年3月より、外科学講座3(肝胆膵外科、乳腺外科、小児外科)教授に就任しました、岸庸二と申します。
前任の山本順司教授が、2008年に防衛医大として初の肝胆膵外科学講座を築き、多大な診療、研究実績を上げてこられました。その功績を引き継ぐ重責を仰せつかり、身の引き締まる思いです。
私は、本校着任前は、東京大学、がん研有明病院、国立がん研究センターに長年在籍し、肝胆膵外科を中心に修練を積んでまいりました。肝胆膵悪性疾患の診療を得意としております。
一般に難治性と呼ばれることが多い肝胆膵悪性腫瘍ですが、地域中核医療施設として、専門性の高い外科治療はもちろんのこと、内科、放射線科、近隣連携施設と協力しながら、集学的治療(複数診療科による総力を挙げての治療)を提供してまいります。
-
資格等
-
 永生 高広
永生 高広-
資格等
- 日本外科学会専門医、指導医
- 日本消化器外科学会専門医、指導医
- 日本消化器病学会専門医、指導医
- 日本肝臓学会肝臓専門医 指導医
- 日本肝胆膵外科学会評議員 高度技術専門医
- 日本乳癌学会専門医 指導医
- 日本がん治療認定医機構がん治療認定医
- マンモグラフィ読影認定医
- ECFMG Certification (アメリカ医師免許)
- da vinci Robot Surgery 術者certification
-
資格等
-
高尾 幹也
-
資格等
- 日本外科学会専門医
- 日本消化器外科学会専門医
- 消化器がん外科治療認定医
- 日本肝胆膵外科学会評議員
-
資格等
-
恒成 崇純
-
資格等
- 日本外科学会専門医
- 日本消化器外科学会専門医
- 消化器がん外科治療認定医
- 日本肝胆膵外科学会評議員
- 日本消化病学会専門医
-
資格等
-
與那嶺 直人
-
資格等
- 日本外科学会専門医
- 日本消化器外科学会専門医
- 消化器がん外科治療認定医
- 日本肝臓学会肝臓専門医
-
資格等
-
小林 和貴
-
資格等
- 日本外科学会専門医
- 日本消化器外科学会専門医
- 消化器がん外科治療認定医
- マンモグラフィ読影認定医
- 緩和ケア講習会修了
-
資格等
-
品田 花絵
-
資格等
- 日本外科学会専門医
- 緩和ケア講習会修了
- da vinci 助手 certification
-
資格等
診療日
診療内容
肝胆膵領域のほとんどの良性疾患(肝損傷、肝膿瘍、胆嚢結石・総胆管結石、胆嚢炎・胆管炎、急性・慢性膵炎)、またあらゆる悪性疾患(原発性肝がん、転移性肝腫瘍、胆管がん、胆のうがん、膵がん)の外科的治療を行います。肝胆膵外科は消化器外科の中でも治療に高度の技術を必要とする領域ですが、豊富な経験と確かな技術をもった医師による高品質な医療を提供します。厚生労働省研究班や日本肝胆膵外科学会が主導する多施設共同研究班にも多数参加しており、日常の臨床経験を将来の診療に役立てるよう努力しています。
特色
当科が外科診療に際して重要と考えるのは、「協調」「高質」「創造」の3つです。つまり、最善の外科治療を行うために、他科、他病院と協力・連携して総合的に診断・治療を行い、正確無比な治療技術を駆使して治療を行い、さらに効率よく同等以上の効果を達成できる方法を模索し取り組む姿勢です。
原発性肝がんに対し、多角的な治療を行います
原発性肝がんのひとつである肝細胞がんはウイルスやアルコールで傷んだ肝臓に発生することがほとんどですが、近年は肥満や糖尿病などを遠因とする非アルコール性脂肪肝炎(NASH)を発生母地とする例も増えています。これらの肝臓は十分な予備力をもたず、また新しい腫瘍が次々に発生しやすいとされています。
ですから、治療にあたっては、肝機能、腫瘍の条件により、外科切除、経皮的局所療法(ラジオ波焼灼、エタノール注入)、経肝動脈的化学塞栓療法を適切に組み合わせる必要があります。また、この数年で、外科切除困難な肝がんに対する化学療法の選択肢が大幅に増え、がんと共存しながらも長期生存できる機会、また、治療が奏功して切除可能になる機会もしばしば経験されるようになってきました。毎週金曜日に行われる内科・外科・放射線科合同カンファレンスで症例ごとに最も適切な治療法を提案します。
転移性肝腫瘍に対し、積極的で根治的な治療を行います
各種の腫瘍に対する化学療法(抗がん剤治療)は年々進歩し、有効性が高まってきていますが、これらにより腫瘍が消失することは通常ありません。腫瘍を根治(根絶)するためには、外科的に取り除く必要があります。とりわけ、大腸がんの肝転移に対しては、化学療法と外科切除を組み合わせることで、高い確率で長期生存を得ることができます。
当院では、豊富な経験に基づき、通常では切除されないような高度の肝転移に対しても、化学療法を併用することにより積極的に切除治療を行っています。
当院は大腸がん手術の症例が非常に多く(下部消化管外科のページをご参照ください)、2000年~2022年に大腸がん肝転移に対して肝切除件数は579件、そのうち243件では肝切除前に化学療法を併用しています。術前に強力な化学療法を行った場合、肝臓が抗がん剤で障害されている(傷んでいる)ことも珍しくありませんが、そのような症例に対しても安全で根治的な外科治療を施行しています。
難治性腫瘍の外科治療を得意としています
難治癌の代表である膵臓がん、切除に高度な技術を要する中部~肝門部胆管がんや進行胆のうがんに対して、積極的な外科治療を行っています。手術と化学療法の組み合わせによる治療成績向上も得られるようになっていますが、今のところがんの完全切除以外にこれらの腫瘍を根治する方法はありません。しかし、切除によってもなかなか根治を得にくく、技術的に高難度かつ通常の手術より合併症などの危険度が高いため、「治療することによるメリット」と「治療に伴うリスク」とのバランスをとることが難しい病態です。
当院では、安全性を高めるための手技上の工夫(術前門脈枝塞栓術によって残肝容積を大きくする、3次元画像構築による手術のプランニングなど)と確かな外科技術によりぎりぎりの手術も安全に施行しています。2019年から2024年までに血管合併切除再建を伴う肝切除、膵切除をそれぞれ8件、49件施行しました。
膵臓がんは難治がんの代表とされています。当院も参加した多施設共同研究により、切除可能膵臓がんであっても術前化学療法を行った後に外科切除を行った方が、手術を先行させるよりも治療成績が良好であったという結果が2019年に得られ(Prep-02/JSAP-05試験)ました。当科では現在、原則として化学療法→外科切除→術後補助化学療法を標準治療としています。診断時、切除が困難とされる場合でも、FOLFIRINOX、ナブパクリタキセルといった抗がん剤による効果が得られる機会が増え、根治切除が可能となる機会も増えてきました。
低侵襲手術(腹腔鏡下手術)に積極的に取り組んでいます
腹部外科手術が体に与える影響の相当部分は、「開腹することでの体壁破壊」によるので、まったく同じ結果が得られるのであれば、創(きず)はできるだけ小さいほうが良いことになります。広く普及している胆のう摘出術に対してのみならず、肝切除、尾側膵切除に対しても、適切な症例に対して腹腔鏡下手術に取り組んでいます。2024年より、手術支援ロボット、ダヴィンチが防衛医科大学校病院に導入され、当科では肝切除に対して使用を始めています。

肝胆膵手術の経験が豊富です
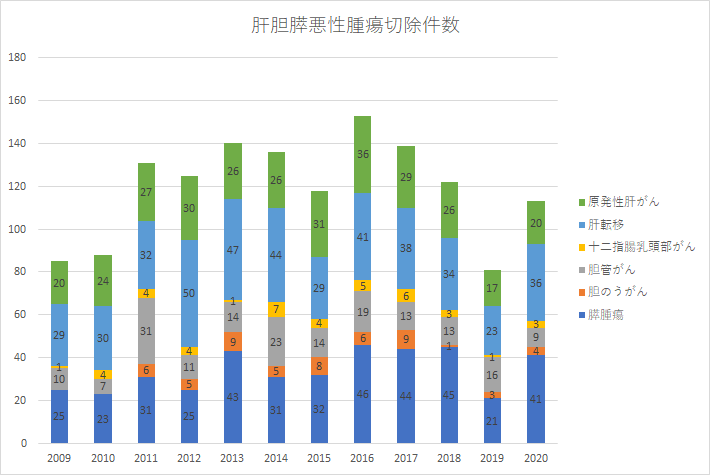
当院では、年間約80例前後の肝切除、40例の膵切除術、20例の胆道悪性腫瘍手術を行っており、年間50例以上の高難度肝胆膵外科手術を施行している施設です。日本肝胆膵外科学会高度技能専門医制度 認定修練施設(A)に認定されており、同制度の高度技能指導医1名、高度技能専門医1名が在籍しています。担当する診療科長の経験症例数は肝切除800例、膵切除500例、肝門部領域胆道悪性腫瘍手術80例と豊富です。肝切除術の70%は無輸血で行われ、術後10日から14日で退院となります。年間肝胆膵悪性腫瘍切除例数(切除に至らなかった件数は除いています)の推移を示します。

患者数、症例数、治療成績、手術件数、入院患者数、根治手術件数(2020年)
| 全手術手術件数 | 154 |
|---|---|
| 肝悪性疾患 | 45例 |
| 胆道良性疾患 | 54例 |
| 胆道悪性疾患 | 5例 |
| 膵腫瘍 | 19例 |
| その他(合流異常など) | 31例 |
肝胆膵悪性腫瘍の切除例数の推移
2009年から2020年まで当科にご紹介いただき外科治療をうけた患者さんは、当院ばかりでなく、自衛隊病院、近隣の研修指定病院の協力を得て、下図のように推移してきています。
研究のお知らせ
公開文書 神経内分泌腫瘍の本態解明の研究
2021年7月6日 第1版
2021年7月20日 第1.1版
1.研究の対象
学校長承認日から2029年3月31日までに国立がん研究センター中央病院および東病院、大津赤十字病院、山形大学病院、防衛医科大学校病院、福岡大学病院、香川大学病院にて神経内分泌腫瘍と診断され、手術を受けた方。
防衛医科大学校においては、防衛医科大学校病院の「組織・体液等の教育・研究への使用に関する説明書」を用いた手術前の説明において、手術検体の組織・体液の教育・研究目的の使用に同意の署名を戴いた方を対象とします。
2.研究目的・方法
本研究の目的は希少がんである神経内分泌腫瘍の本態解明に役立つ知見を得ることです。神経内分泌腫瘍(NeuroEndocrine Neoplasm: NEN)は、膵臓・下垂体など、全身の様々な臓器に生じます。各臓器のNENは希少がんであるため、患者症例の収集効率が低いこと、かつ研究に用いることができる細胞株などが不足していることが大きな障壁となり、発症・進展機序の解明が進んでいません。本研究ではNENの本態を解明することで、新しいNEN診断・治療法の開発につながる成果を得ることを目的としており、NEN最適医療の推進に資するものです。
具体的には、治療のために切除されたがん組織などを、実験動物に移植したり、シャーレの中など腫瘍細胞の増殖に適した環境で育てます。腫瘍組織や細胞が順調に増殖したら、いったん超低温で凍らせて保存します。そして、研究に応じて溶かして再度増殖させ実験に使用します。実験の内容としては、遺伝子やタンパク質などを調べます。
本研究は、国立がん研究センター中央病院および東病院、大津赤十字病院、山形大学病院、防衛医科大学校病院、福岡大学病院、香川大学病院との共同研究です。国立がん研究センター中央病院および東病院、大津赤十字病院、山形大学病院、防衛医科大学校病院、福岡大学病院、香川大学病院は、「神経内分泌腫瘍」においては国内最大の手術件数であり、長年にわたる経験において神経内分泌腫瘍の患者さんの治療を行っております。本研究では、国立がん研究センター中央病院および東病院、大津赤十字病院、山形大学病院、防衛医科大学校病院、福岡大学病院、香川大学病院から国立がん研究センター研究所に研究に必要な腫瘍組織などを輸送します。そして国立がん研究センター研究所おいて腫瘍組織から細胞株の樹立を行います。作製されたモデル系は、国立がん研究センター研究所においては新しい治療法開発の基礎研究に使用します。
研究実施期間は学校長承認日から2030年3月31日を予定しています。
3.研究に用いる情報・試料の種類
本研究では、診療のために採取された臨床材料の中から、診断・治療に必要のない部分を本研究に使用します。具体的には、腫瘍組織、血液、腹水などです。個人情報を保護する担当者が責任を持って臨床検体を匿名化し、対応表は研究責任者が保管・管理します。本研究全体を通して、患者さんの個人情報が流出することが絶対にないよう細心の注意を払います。新しい治療法の開発に必要になる可能性のある基本的な臨床病理情報を研究に使用します。具体的には、以下の項目などです。
- 年齢(層)
- 性別
- 臨床病期
- 病理診断
- 初発・再発
- 前治療の有無
4.試料・情報の公表
研究結果については、研究責任者あるいは研究担当者が、論文発表及び学会発表等の形で公表します。論文は可能な限りNCBI の公開データベース(https://www.ncbi.nlm.nih.gov/pubmed/)に登録し、世界中の方が閲覧できるようにします。論文公表の際に、個人が特定されることはありません。
5.研究組織
共同研究施設
国立がん研究センター中央病院
国立がん研究センター東病院
防衛医科大学校 肝・胆・膵外科
大津赤十字病院
香川大学医学部 病理病態・生体防御医学講座
腫瘍病理学
山形大学大学院 医学系研究科医学専攻
外科学第一講座
福岡大学病院 再生医療センター 消化器外科
研究責任者
江崎 稔国立がん研究センター中央病院
肝胆膵外科・科長
平岡 伸介国立がん研究センター中央病院
病理診断科・医長
後藤田 直人国立がん研究センター東病院
・肝胆膵外科長
小嶋 基寛国立がん研究センター東病院
臨床腫瘍病理分野・ユニット長
岸 庸二防衛医科大学校 肝・胆・膵外科
・教授
土井 隆一郎大津赤十字病院・副院長・外科部長
松田 陽子香川大学医学部 病理病態・生体
防御医学講座 腫瘍病理学・教授
元井 冬彦山形大学大学院 医学系研究科
医学専攻 外科学第一講座・教授
吉松 軍平福岡大学病院 再生医療センター
消化器外科・准教授
6.お問い合わせ先
本研究に関するご質問等がありましたら下記の連絡先までお問い合わせ下さい。ご希望があれば、他の研究対象者の個人情報及び知的財産の保護に支障がない範囲内で研究の内容について御説明します。また、試料・情報が当該研究に用いられることについて患者さんもしくは患者さんの代理人の方にご了承いただけない場合には研究対象としませんので、下記の連絡先までお申出ください。その場合でも患者さんに不利益が生じることはありません。
研究責任者連絡先
〒359-8513 埼玉県所沢市並木3-2
TEL 04-2995-1211(代表)FAX 04-2996-5205
防衛医科大学校 肝・胆・膵外科・教授
岸 庸二 (内線5508)
研究代表者連絡先
〒104-0045 東京都中央区築地5-1-1
TEL 03-3542-2511(代表)FAX 03-3547-5298
国立がん研究センター研究所 基礎腫瘍学ユニット
独立ユニット長大木理恵子(内線:3833)
情報公開文書
リンパ節転移を伴うT2以下胆のうがんの外科切除後予後の解析
Postoperative prognosis of the patients with node-positive T1/2 gallbladder cancer
1.研究の対象
当院で2000年1月1日から2021年12月31日までに胆嚢がんに対して外科手術を受けられた方。
2.研究目的・方法
胆嚢がんは、いまだに早期発見が難しいがんの一つで、診断時には切除ができないほど進行していることもしばしばあります。胆嚢は肝臓の下側に付着する、胆汁(脂肪の消化を助ける働きをする、肝臓で作られ、小腸に分泌される、便の色のもとにもなる、黄色い液体)を一時的にためる袋状の臓器です。胆嚢の壁は非常に薄いため、壁の内側から発生する胆嚢がんは、容易に壁の外に広がり、隣接する周囲の臓器(肝臓、胆管、十二指腸、大腸など)へ浸潤し、進行がんとなります。一方、胆嚢の壁内にとどまるものの、周囲のリンパ節へ広く転移するタイプもあります。これは、リンパ節転移型の胆嚢がんと呼ばれていますが、どの範囲のリンパ節転移が該当するのか、明確に定まってはおらず、外科切除の適応や治療成績についても定まった見解がありません。胆のうがんは消化器がんの中では比較的頻度がすくなく、一施設の経験では十分な知見が得られないため、胆のうがん切除症例が多い国内の複数の施設で、過去に治療を行った患者さんのデータを利用し、上記の疑問(リンパ節転移型胆のうがんの頻度、治療成績)に対する検証をおこなうことが本研究の目的です。
転移していたリンパ節の部位、転移リンパ節個数のデータをもとに、広範なリンパ節転移を有する症例を拾い上げ、そのうち、胆嚢がん原発巣の局所の進展が限局(胆嚢壁内にとどまり、隣接臓器への浸潤が無い、もしくは小範囲に限られている)している症例をリンパ節転移型胆嚢がんとし、その頻度、予後を解析します。
研究参加施設(北海道大学、慶應大学、がん研有明病院、静岡がんセンター、名古屋大学、防衛医科大学校)における、対象患者さん(2000年から2021年の胆嚢がん外科切除症例)は、事前のアンケート調査の結果、800名ほどで、このうち、防衛医科大学校病院で手術を受けられた方は、75名いらっしゃいます。
研究期間は、研究許可日から、対象患者さんの経過観察期間終了(2026年10月31日)1年後の2027年10月31日までです。
3.研究に用いる試料・情報の種類
- 背景情報:年齢、性別、術前の身長、体重、診断名、過去の病歴など
- 腫瘍マーカー(CEA/CA19-9)含む、術前血液検査結果
- CT・MRIなどの画像検査結果
- 病理組織学的検査結果(リンパ節転移、ステージ)
- 施行術式・手術時間・出血量・輸血量
- 術後合併症
- 術後治療(化学療法など)の有無・期間
- 再発までの期間・再発部位・生命予後・最終通院日
4.研究に用いる試料・情報の管理者
管理者:岸庸二 (防衛医科大学校外科学講座3教授、本研究の研究代表者)
個人情報管理補助者:山崎民大 (外科学講座3講師、乳腺外科科長)
本研究目的に作成するデータベースには、患者さん個人を特定可能な、氏名、診察券番号などは含みません。研究用のID番号を作成し、直ぐには個人を特定できないように加工したもの(仮名加工情報)を作成し、各研究参加施設間での情報共有においてはこれを利用します。各施設で別に作成する対応表および個人を特定できる復元情報は各施設の研究責任者が厳重に管理し、施設間での共有は行いません。防衛医科大学校においては、施錠可能な外科学講座3教授室内に設置された、パスワード保護されたデスクトップPCのハードディスク内で保存し、個人情報管理補助者:山崎民大が管理します。データベースは、この研究に参加する研究者のみで利用します。
5.外部への試料・情報の提供
防衛医科大学校と研究参加施設との間で、上記3に記載した診療情報を、パスワード保護をしたファイルによって、電子メールにて授受を行います。授受の日時、送信者及び受信者の氏名を含めた記録は当校、それぞれの機関の研究責任者が保管・管理します。
6.研究組織
本研究の参加施設並びに各施設の責任者は以下の通りです。
防衛医科大学校外科学講座3 岸 庸二
北海道大学消化器外科II 野路 武寛
慶応大学一般・消化器外科 阿部 雄太
がん研有明病院肝胆膵外科 高橋 祐
静岡がんセンター肝胆膵外科 杉浦 禎一
名古屋大学腫瘍外科 水野 隆史
7.お問い合わせ先
本研究に関するご質問等がありましたら下記の連絡先までお問い合わせ下さい。
ご希望があれば、他の研究対象者の個人情報及び知的財産の保護に支障がない範囲内で、研究計画書及び関連資料を閲覧することが出来ますのでお申出下さい。
また、試料・情報が当該研究に用いられることについて患者さんもしくは患者さんの代理人の方にご了承いただけない場合には研究対象としませんので、下記の連絡先までお申出ください。その場合でも患者さんに不利益が生じることはありません。
照会先および研究への利用を拒否する場合の連絡先:
氏名 永生 高広
所属 防衛医科大学校外科学講座3
住所 〒359-8513 埼玉県所沢市並木3-2
TEL 04-2995-1211(内線2356 対応時間:平日9時から16時)
FAX 04-2996-5205
研究責任者:
氏名 岸 庸二
所属 防衛医科大学校外科学講座3
研究代表者:
氏名 岸 庸二
所属 防衛医科大学校外科学講座3
当科の実績
【2013年】
- J. Yamamoto et al. Right-sided retrocaval approach using guidance via the lesser sac for Spieghel lobe resection. Surgery. 153(2):282-286, 2013.
- M. Ikarashi et al. Distinct development and functions of resident and recruited liver Kupffer cells/macrophages. J Leukoc Biol. 94(6):1325-1336, 2013.
- Y. Kishi et al. “Surgical resection for small hepatocellular carcinoma in cirrhosis: the Eastern experience.” p.69-84. Multidisciplinary Treatment of Heptacocellular carcinoma. Springer, 2013.
- 岸庸二ほか. 「【肝切除をめぐる最近の話題】 肝切除安全限界は残肝何%か.」 外科. 75:1141-1145, 2013.
- 岸庸二ほか. 「【肝・胆道外科における胆管処理のすべて】 胆管再建後吻合部狭窄 肝S4部分切除を伴う胆管・空腸再吻合.」 手術. 67:47-51, 2013.
【2014年】
- A. Kimura et al. Multifocal lesions with pancreatic atrophy in IgG4-related autoimmune pancreatitis: report of a case. Surg Today. 44(6):1171-1176, 2014.
- S. Aosasa et al. Risk factors and prevention of surgical site infection for colorectal surgery. Nihon Rinsho. 72(1):150-153, 2014.
- 岩崎寿光ほか. 後腹膜脂肪肉腫術後再発に対してスペーサー手術および陽子線照射による2段階治療が奏功した1例. 日本消化器外科学会雑誌. 47(7):403-409, 2014.
- Y. Kishi et al. Basing treatment strategy for non-functional pancreatic neuroendocrine tumors on tumor size. Ann Surg Oncol. 21:2882-2888, 2014.
- Y. Kishi et al. Role of hepatectomy for recurrent or initially unresectable hepatocellular carcinoma. World J Hepatol. 6:836-843, 2014.
- 宮田陽一ほか. 混合型肝癌に対するソラフェニブの補助化学療法を行った1例. The Liver Cancer Journal. 6(2):136-137, 2014.
- 岸庸二ほか. 「左葉亜区域切除」p.158-167. がん研スタイル 癌の標準手術 肝癌 (山口俊晴、齋浦明夫編)MEDICAL VIEW 2014.
【2015年】
- S. Aosasa et al. Intrahepatic Cholangiocarcinoma With Lymphoepithelioma-like Carcinoma Components Not Associated With Epstein-Barr Virus: Report of a Case. Int Surg. 100(4):689-695, 2015.
- K. Nishiyama et al. Mouse CD11b+Kupffer Cells Recruited from Bone Marrow Accelerate Liver Regeneration after Partial Hepatectomy. PLos One. 10(9):e0136774, 2015.
- S. Aosasa et al. Long great saphenous vein grafting as temporary coronary bypass for extended left hepatectomy: report of a case. Surg Case Rep. 1(1):8, 2015.
- T. Einama et al. Importance of luminal membrane mesothelin expression in intraductal papillary mucinous neoplasms. Oncol Lett. 9(4):1583-1589, 2015.
- 岩崎寿光ほか. 胆嚢癌との鑑別が困難であった胆嚢および消化管浸潤を伴う肝内胆管癌の1例. 癌の臨床. 61:125-129, 2015.
- 岸庸二ほか. 「門脈塞栓術」p.20-21. がん研スタイル 癌の標準手術 膵癌・胆道癌 (山口俊晴、齋浦明夫編)MEDICAL VIEW 2015.
【2016年】
- S. Aosasa et al. Total Pancreatectomy with Celiac Axis Resection and Hepatic Artery Restoration Using Splenic Artery Autograft Interposition. J Gastrointest Surg. 20(3):644-647, 2016.
- S. Aosasa et al. Inframesocolic Superior Mesenteric Artery First Approach as an Introductory Procedure of Radical Antegrade Modular Pancreatosplenectomy for Carcinoma of the Pancreatic Body and Tail. J Gastrointest Surg. 20(2):450-454, 2016.
- T. Tsunenari et al. Synchronous neuroendocrine tumors in both the pancreas and ileum: A case report. Int J Surg Case Rep. 22:47-50, 2016.
- M. Nishikawa et al. The impact of postoperative adjuvant chemotherapy on the development of nonalcoholic fatty liver disease after pancreatoduodenectomy. J Surg Res. 205(1):7-135, 2016.
- T. Einama et al. Clinical impacts of mesothelin expression in gastrointestinal carcinomas. World J Gastrointest Pathophysiol. 7(2):218-222, 2016.
- Y. Kishi et al. The type of preoperative biliary drainage predicts short-term outcome after major hepatectomy. Langenbecks Arch Surg. 401:503-511, 2016.
- Y. Miyata et al. Pharmacokinetics of a Once-Daily Dose of Tacrolimus Early After Liver Transplantation: With Special Reference to CYP3A5 and ABCB1 Single Nucleotide Polymorphisms. Ann Transplant. 21:491-499, 2016.
- 宮田陽一ほか. 「S3+S4, S4, S3, S2切除」 p.419-424. 肝胆膵高難度外科手術手技アトラス(手術3月臨時増刊号). 2016.
【2017年】
- T. Einama et al. Mesothelin-Specific Immune Responses and Targeted Immunotherapy for Mesothelin-Expressing Tumors. EBioMedicine. Oct; 24:16-17, 2017.
- T. Einama et al. Long-term survival and prognosis associated with conversion surgery in patients with metastatic gastric cancer. Mol Clin Oncol. 6(2):163-166, 2017.
- 岸 庸二ほか. 小型膵神経内分泌腫瘍の切除適応 【1cm以下の早期濃染される膵腫瘤は経過観察可】. 日本医事新報. 4861:55-56, 2017.
- Y. Kishi et al. Salvage hepatectomy for local recurrence of hepatocellular carcinomas offers survival comparable to that of matched patients who undergo primary hepatectomies. Eur J Surg Oncol. 43:1075-1082, 2017.
- Y. Miyata et al. Intraoperative imaging of hepatic cancers using γ-glutamyltranspeptidase-specific fluorophore enabling real-time identification and estimation of recurrence. Sci Rep. 7(1):3542, 2017.
- 宮田陽一ほか. 高度閉塞性黄疸下で水稲十二指腸切除術を施行した1例. 癌と化学療法. 44(12):1284-1286, 2017.
【2018年】
- T. Einama et al. Curative resection of pancreatic ductal adenocarcinoma developing in the remnant pancreas 13 years after distal pancreatectomy for intraductal papillary mucinous neoplasms: A case report. Mol Clin Oncol. 8(3):417-420, 2018.
- T. Einama et al. Optimal resection area for superior mesenteric artery nerve plexuses after neoadjuvant chemoradiotherapy for locally advanced pancreatic carcinoma. Medicine(Baltimore). 97(31):e11309, 2018.
- Y. Kishi et al. Extent of lymph node dissection in patients with gallbladder cancer. Br J Surg. 102:1658-1664, 2018.
- Y. Kishi et al. Feasibility of "Watch-and-Wait" Management before Repeat Hepatectomy for Colorectal Liver Metastases. Dig Surg. 36:233-240, 2018.
【2019年】
- K. Nagata et al. A case of intrahepatic cholangiocarcinoma that was difficult to diagnose prior to surgery: A case report. Oncol Lett. Jan;17(1):823-830, 2019.
- Y. Imonot et al. Laparoscopic fenestration for a large ruptured splenic cyst combined with an elevated serum carbohydrate antigen 19-9 level: a case report. BMC Surg. 19(1):58, 2019.
- T. Iwasaki et al. Reduction of intrapancreatic neural density in canceer tissue predicts poorer outcom in pancreatic ductal carcinoma. Cancer Sci. 110(4):1491-1502, 2019.
- T. Iwasaki et al. Surgical treatment of neuroendocrine tumors in the second portion of the duodenum: a single center experience and systematic review of the literature. Arch Surg. 402(6):95-933, 2019.
- Y. Kishi et al. Feasibility of resecting the portal vein only when necessary during pancreatoduodenectomy for pancreatic cancer. BJS Open. 3:327-335, 2019.
- M. Nishikawa et al. Stapler sizes optimized for pancreatic thickness can reduce pancreatic fistula incidence after distal pancreatectomy. Surg Today. 2019 Nov 30.
- N. Hiraoka et al. Tissue amino acid profiles are characteristic of tumor type, malignant phenotype, and tumor progression in pancreatic tumors. Sci Rep. 2019 Jul 8;9(1):9816.
- S. Sugawara et al. Retrospective Comparative Study of Absolute Ethanol with N-Butyl-2-Cyanoacrylate in Percutaneous Portal Vein Embolization. J Vasc Interv Radiol. 2019 Aug;30(8):1215-1222.
- D. Asano et al. A Single-Institution Validation Study of Lymph Node Staging By the AJCC 8th Edition for Patients with Pancreatic Head Cancer: A Proposal to Subdivide the N2 Category. Ann Surg Oncol. 2019 Jul;26(7):2112-2120.
- A. Nakamura et al. Three risk factors for pulmonary metastasectomy in patients with hepatocellular carcinoma. Gen Thorac Cardiovasc Surg. 2019 Sep;67(9):782-787.
- Y. Kishi et al. Feasibility of "Watch-and-Wait" Management before Repeat Hepatectomy for Colorectal Liver Metastases. Dig Surg. 2019;36(3):233-240.
- H. Nagata et al. A patient with a pancreatic neuroendocrine tumor and multiple liver metastases achieved a long-term partial response to third-line streptozocin treatment. Int Cancer Conf J. 2019 Nov 28;9(1):45-49.
- S Soga et al. Double Balloon-Occluded Transarterial Chemoembolization (Double B-TACE) for Hepatocellular Carcinomas Located in the Caudate Lobe. Cardiovasc Intervent Radiol. 2020 Jan;43(1):162-164.
- T. Akasaki et al. Successful resection of a granulocyte colony-stimulating factor-producing carcinoma of the pancreas: A case report. Mol Clin Oncol. 2019 Oct;11(4):359-363.
- T. Iwasaki et al. Identification of aberrant subvesical bile duct by using intraoperative fluorescent cholangiography: A case report. Int J Surg Case Rep. 2019;61:115-118.
- T. Iwasaki et al. A Successful Surgical Treatment of Postoperative Hepato-Venous Fistula. Int J Surg Res Pract 2020, 7:109.
- T. Iwasaki et al. Proposal of a Clinically Useful Criterion for Early Drain Removal After Pancreaticoduodenectomy. J Gastrointestinal Surg. 2020, Mar 27.
- 西牧 宏泰 他. 経皮経肝的門脈塞栓術後にComplete necrosisをきたした巨大肝細胞癌の1例(原著論文/症例報告). 肝臓 (0451-4203)60巻10号 Page382-387(2019.10)
- 江崎 稔 他. 【肝門部領域胆管癌:残された問題をどう解決すべきか?】左三区域切除術における注意点は?(解説/特集). 胆と膵 (0388-9408)40巻5号 Page409-414(2019.05)
- 江崎 稔 他. 【高度進行消化器癌に対する手術】肝・胆・膵 広範囲胆管癌に対する肝膵同時切除(解説/特集). 手術 (0037-4423)73巻4号 Page609-619(2019.03)
【2020年】
- T. Iwasaki et al. A Successful Surgical Treatment of Postoperative Hepato-Venous Fistula. Int J Surg Res Pract 2020, 7:109.
- T. Iwasaki et al. Proposal of a Clinically Useful Criterion for Early Drain Removal After Pancreaticoduodenectomy. J Gastrointestinal Surg. 2020, Mar 27.
- Iwasaki T, Nara S, Nishimura Y, Ueda H, Kishi Y, Esaki M, Shimada K, Hiraoka N.Postoperative acute multiple organ failure after hepatectomy in a Nigerian male with sickle cell trait: a case report Surg Case Rep. 13(1) 19. doi: 10.1186/s40792-020-01102-6., 2021
- Kikuya K, Einama T, Miyata Y, Iwasaki T, Yamagishi Y, Takihata Y, Morimura F, Edo H, Otsuka Y, Mori S, Tsunenari T, Fujinuma I, Hirose Y, Tsujimoto H, Ueno H, Kishi Y. Destruction of a wandering accessory right hepatic artery in a patient with pancreatic body cancer: a case report. Clin J Gastroenterol. 2021 Jan 4. doi: 10.1007/s12328-020-01304-3. Online ahead of print. PMID: 33394330
- Nishikawa M, Kinoshita M, Morimoto Y, Ishikiriyama T, Nakashima M, Nakashima H, Ono T, Seki S, Moriya T, Yamamoto J, Kishi Y. Lipopolysaccharide preconditioning reduces liver metastasis of Colon26 cells by enhancing antitumor activity of natural killer cells and natural killer T cells in murine liver J Gastroenterol Hepatol. 2020 Dec 16. doi: 10.1111/jgh.15375. Online ahead of print.
- Iwasaki T, Otsuka Y, Miyata Y, Einama T, Tsujimoto H, Ueno H, Ogata S, Kishi Y. Intracholecystic papillary neoplasm arising in a patient with pancreaticobiliary maljunction: a case report. World J Surg Oncol. 2020 Nov 9;18(1):292. doi: 10.1186/s12957-020-02072-7. PMID: 33168026
- Kishi Y, Vauthey JN. Issues to be considered to address the future liver remnant prior to major hepatectomy. Surg Today. 2020 Sep 7. doi: 10.1007/s00595-020-02088-2. Online ahead of print. PMID: 32894345
- Hiraoka N, Nitta H, Ohba A, Yoshida H, Morizane C, Okusaka T, Nara S, Esaki M, Kishi Y, Shimada K. Details of human epidermal growth factor receptor 2 status in 454 cases of biliary tract cancer. Hum Pathol. 2020 Nov;105:9-19. doi: 10.1016/j.humpath.2020.08.006. Epub 2020 Sep 3. PMID: 32891647
- Tashiro K, Kuroki N, Einama T, Iwasaki T, Miyata Y, Aosasa S, Inoue Y, Takahashi Y, Ogata S, Ueno H, Hase K, Yamamoto J, Kishi Y. Prognostic significance of regional lymph node metastasis according to station in ampullary carcinoma. J Hepatobiliary Pancreat Sci. 2020 Oct;27(10):712-720. doi: 10.1002/jhbp.791. Epub 2020 Jul 30. PMID: 32578342
- Hiraoka N, Ino Y, Hori S, Yamazaki-Itoh R, Naito C, Shimasaki M, Esaki M, Nara S, Kishi Y, Shimada K, Nakamura N, Torigoe T, Heike Y. Expression of classical human leukocyte antigen class I antigens, HLA-E and HLA-G, is adversely prognostic in pancreatic cancer patients. Cancer Sci. 2020 Aug;111(8):3057-3070. doi: 10.1111/cas.14514. Epub 2020 Jul 9. PMID: 32495519
- Morita S, Suda T, Kishi Y, Iwasaki T, Hiraoka N, Nagayama I, Hoshi T, Abe S, Yagi K, Hasegawa G, Ikarashi T, Terai S. Synchronous Double Bile Duct Cancers with Distinct Genetic Features. Intern Med. 2020 Sep 1;59(17):2129-2134. doi: 10.2169/internalmedicine.4613-20. PMID: 32493852
- Nishikawa M, Yamamoto J, Hoshikawa M, Einama T, Noro T, Aosasa S, Tsujimoto H, Ueno H, Kishi Y. Stapler sizes optimized for pancreatic thickness can reduce pancreatic fistula incidence after distal pancreatectomy. Surg Today. 2020 Jun;50(6):623-631. doi: 10.1007/s00595-019-01929-z. Epub 2019 Nov 30. PMID: 31786683



